La formidable histoire
des CELLULES CAR-T
Comment sont produites les cellules CAR-T ?
Une cellule CAR-T, c’est quoi ?
Une cellule CAR-T est un lymphocyte T qui porte à sa surface un récepteur chimérique, c’est-à-dire qui a été créé en laboratoire. Ce récepteur est appelé CAR, pour Chimeric Antigen Receptor (Récepteur Antigénique Chimérique).
Les cellules CAR-T sont basées sur une technologie innovante qui consiste à prélever les cellules immunitaires d’un patient, à les « reprogrammer » génétiquement afin de les rendre capables de reconnaître et détruire les cellules cancéreuses, puis à les réinjecter au patient. Elles ont été reconnues comme « médicaments innovants » par différentes Autorités de santé.
Il s’agit ainsi, contrairement aux traitements conventionnels, d’une approche personnalisée, c’est pourquoi la production se fait à la demande des médecins habilités, spécifiquement pour un patient donné.
Innovation thérapeutique, les cellules CAR-T font déjà partie du quotidien de certains centres experts et plusieurs médicaments ont obtenu leur Autorisation de Mise sur le Marché en Europe en 2018 dans les cancers du sang.
La production des cellules CAR-T constitue un cycle qui commence à l’hôpital, où les lymphocytes T du patient sont prélevés. Ces cellules sont ensuite transmises au site de production pour y être modifiées, contrôlées et multipliées. Le cycle se termine à l’hôpital pour une réinjection au patient de ses propres cellules modifiées.
Production des cellules CAR-T
Passez votre souris sur les numéros du schéma ci-dessous pour découvrir les 5 étapes du traitement par les cellules CAR-T.
Etape 1
Le prélèvement se fait par une technique appelée leucaphérèse*. Elle permet de prélever dans le sang des cellules spécifiques, ici les lymphocytes T.
* Technique permettant d’isoler des globules blancs des autres composants du sang.
Etape 2
Sur le site de production, les lymphocytes T sont modifiés génétiquement (modification ex vivo). On utilise un virus, rendu inoffensif, pour introduire un nouveau gène dans les lymphocytes T. Ce nouveau gène permet aux lymphocytes T d’exprimer à leur surface un récepteur chimérique appelé CAR qui leur servira à détecter les cellules cancéreuses. Les lymphocytes T modifiés sont maintenant des cellules CAR-T.
Etape 3
Les cellules CAR-T sont multipliées in vitro, contrôlées, conditionnées puis transportées vers l’hôpital. La fabrication des cellules CAR-T est un processus complexe et long qui peut être impacté par de nombreux paramètres : nombre de lymphocytes T prélevés chez le patient au départ ou leurs caractéristiques intrinsèques par exemple. Le processus de fabrication du médicament prend généralement quelques semaines. Dans cet intervalle de temps, le patient peut être traité par chimiothérapie pour contrôler sa maladie.
Etape 4
Le traitement par cellules CAR-T nécessite la réalisation d’une chimiothérapie spécifique dite lympho-déplétive*, quelques semaines ou quelques jours avant l’injection des cellules CAR-T, afin de créer un environnement favorable à leur multiplication dans l’organisme.
* Chimiothérapie qui permet de diminuer le nombre de lymphocytes dans le corps.
Etape 5
Les cellules CAR-T sont injectées au patient par une transfusion qui dure moins de 30 minutes. Une fois dans l’organisme, les cellules CAR-T vont reconnaitre et détruire les cellules cancéreuses. Elles vont également se multiplier et rester dans l’organisme.
Après l’injection, l’efficacité du traitement est évaluée régulièrement.
Pour en savoir plus
Le terme autologue est utilisé pour une greffe (organe, cellules) lorsque le donneur et le receveur sont la même personne.
C’est le cas des cellules CAR-T, puisque ce sont les cellules du patient qui lui sont réinjectées après modification.
L’utilisation de cellules autologues est un point important dans la production des cellules CAR-T. En effet, la qualité et la quantité de lymphocytes T prélevés lors de la leucaphérèse peuvent avoir un impact sur la production.
La protéine chimérique (CAR) est différente selon la maladie ciblée. En effet, cette protéine sert à reconnaître les cellules cancéreuses. Pour cela, il faut qu’elle puisse identifier à leur surface un élément particulier, qu’on appelle antigène. La protéine CAR sera donc adaptée en fonction de la maladie à traiter.
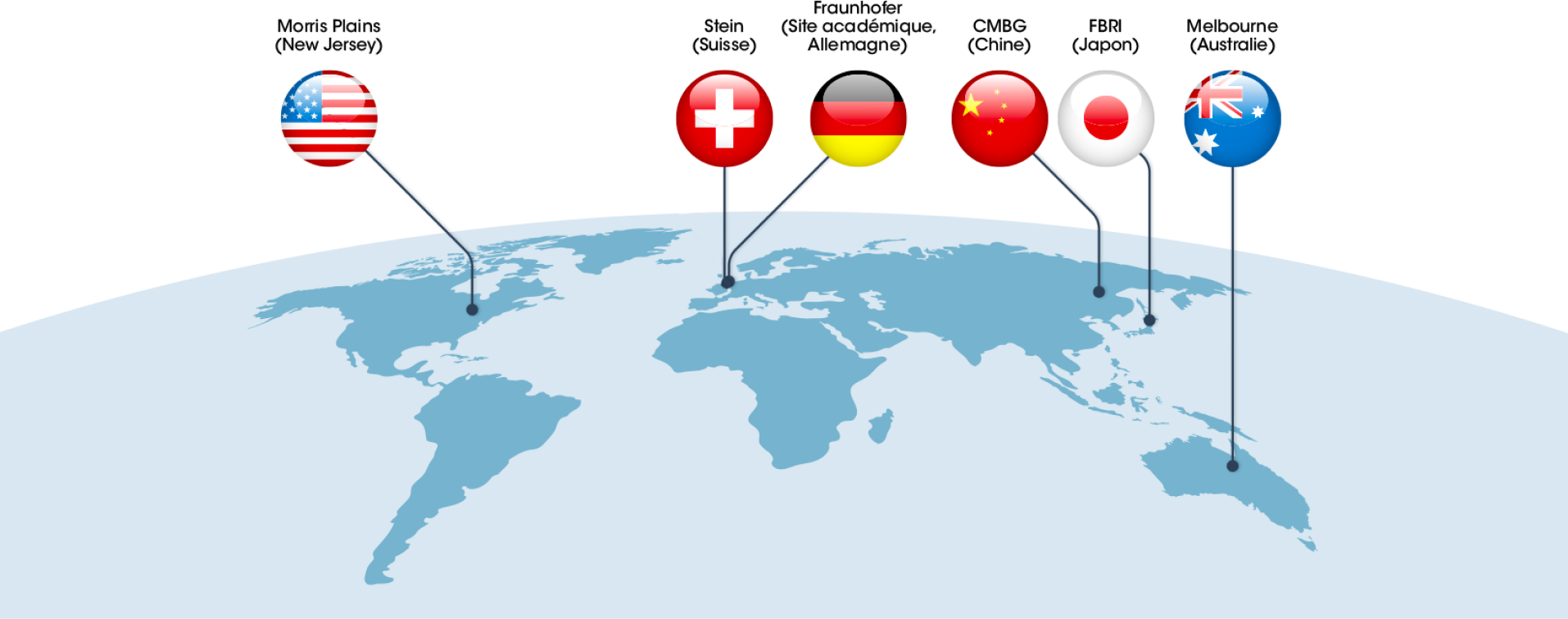
Où sont produites les cellules CAR-T ?
Le lieu du site de production est un élément clé de qualité et de gain de temps dans le circuit de prise en charge du patient. Sa proximité avec les hôpitaux peut permettre de gagner quelques jours de transport.
La production des cellules CAR-T doit en effet répondre à des critères spécifiques et précis en termes d’équipements matériels, de personnel, de procédés de fabrication, de contrôles du produit fini et de certification, tout en permettant l’acheminement des cellules CAR-T au patient dans les meilleurs délais.


Pour en savoir plus
Lors de la production des cellules CAR-T, il n’y a aucun droit à l’erreur : dans le cas d’un produit autologue, les cellules sont prélevées sur le patient et il est impossible de les remplacer par d’autres.
C’est pourquoi les cellules CAR-T représentent un défi en terme de QUALITÉ et de RAPIDITÉ.
La production des cellules CAR-T doit en effet répondre à des critères spécifiques et précis en termes d’équipements matériels, de procédés de fabrication, d’analyses du produit fini et de certification. La formation du personnel, encore plus longue et poussée que pour les produits biopharmaceutiques classiques, implique l’habilitation des différents opérateurs aux Bonnes Pratiques de Fabrication en milieu stérile (culture de cellules, cytométrie, méthodes analytiques, transduction, etc).
L’autre enjeu majeur est celui de la rapidité, afin de pouvoir produire et acheminer les cellules CAR-T dans les meilleurs délais au lit du patient, dans le contexte de maladies à évolution rapide. Cette logistique complexe nécessite une maîtrise du planning, des timings de production et de la chaîne du froid.
Le maniement et l’administration des cellules CAR-T nécessitent un fort niveau d’expertise et des méthodologies validées réservées à des centres hospitaliers experts déclarés et répondant aux critères définis par les Autorités de Santé.
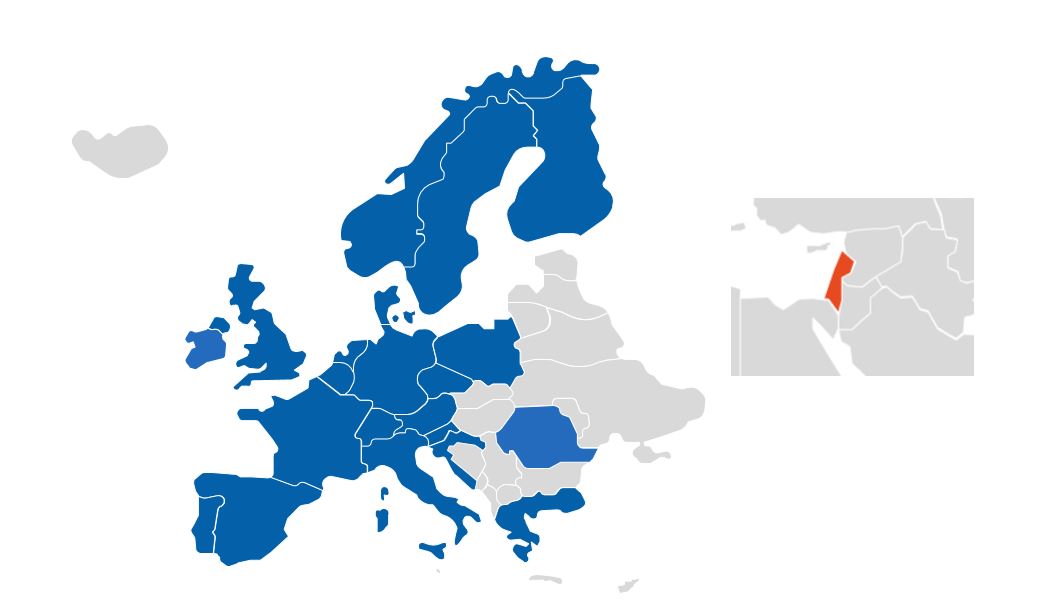
Novartis travaille en permanence à mettre les cellules CAR-T à disposition d’un nombre croissant de pays, afin de permettre un accès à tous les patients européens.
Aujourd’hui, 218 centres sont habilités en Europe à utiliser des cellules CAR-T dans plus de 22 pays, dont plus de 33 en France.*
*Sources actualisées à la date de publication de ce document, susceptibles de modifications.
Selon un arrêté du 8 août 2019, modifiant l’arrêté du 28 mars 2019, le traitement doit se faire dans un centre qualifié, autorisé à prélever les lymphocytes T et à administrer les cellules CAR-T. Par ailleurs, cet arrêté a été mis à jour avec un arrêt paru le 19 mai 2021.
Les établissements de santé qui utilisent les cellules CAR-T doivent également se déclarer auprès de l’Agence de Santé Régionale (ARS) territoriale compétente.
Principaux critères pour l’autorisation au prélèvement des lymphocytes T
- Établissement autorisé à prélever des cellules à des fins thérapeutiques.
- Possibilité de stockage des cellules prélevées dans l’attente de leur prise en charge par l’établissement pharmaceutique exploitant l’AMM.
Principaux critères pour l’autorisation à l’administration des cellules CAR-T
- Présence d’une équipe pluridisciplinaire pouvant organiser des réunions de concertation d’hémato-oncologie afin de confirmer l’éligibilité du patient au traitement par les cellules CAR-T.
- Établissement disposant d’une pharmacie à usage intérieur autorisée à la reconstitution des médicaments de thérapie innovante et assurant notamment la réception, la conservation, la reconstitution en vue de l’administration au patient ainsi que la dispensation des cellules CAR-T.
- Disponibilité d’équipes médicales, pharmaceutiques, paramédicales et techniques préalablement formées à la réception, la conservation, la manipulation, le transport et l’administration des cellules CAR-T.
- Établissement disposant d’une unité de soins intensifs permettant l’accueil des patients traités par cellules CAR-T. Cette unité de soins intensifs doit être dotée d’un accès à une unité ou un secteur protégé comportant des chambres équipées d’un système de traitement et de contrôle de l’air.
- Accessibilité sur place et permanente à une activité de réanimation médicale.
- Établissement de santé organisant ses activités cliniques pour permettre à un neurologue de procéder à l’évaluation initiale des patients traités par cellules CAR-T et d’être présent sur place dans un délai compatible avec l’impératif de sécurité durant toute la prise en charge hospitalière des patients traités par cellules CAR-T.
- Accès sur site à des plateaux techniques permettant la réalisation d’IRM et disponibilité d’un radiologue dans des délais compatibles avec l’état clinique du patient.
- Établissement permettant une coordination immédiate et permanente entre hémato-oncologues, réanimateurs et neurologues formés à l’administration des cellules CAR-T et au suivi des patients traités par cellules CAR-T.
- Établissement ayant les médicaments précisés par l’AMM à disposition et prêts à l’emploi.
- Les centres d’administration des cellules CAR-T en pédiatrie doivent répondre aux mêmes exigences que les centres d’adultes.
Pour consulter les arrêtés du 28 mars 2019 et du 8 août 2019
Cliquez iciQuels changements dans le parcours de soins ?
Une utilisation réservée aux centres experts
Le maniement et l’administration des cellules CAR-T nécessitent un fort niveau d’expertise et des méthodologies validées réservées à des centres hospitaliers experts déclarés et répondant aux critères définis par les Autorités de Santé.
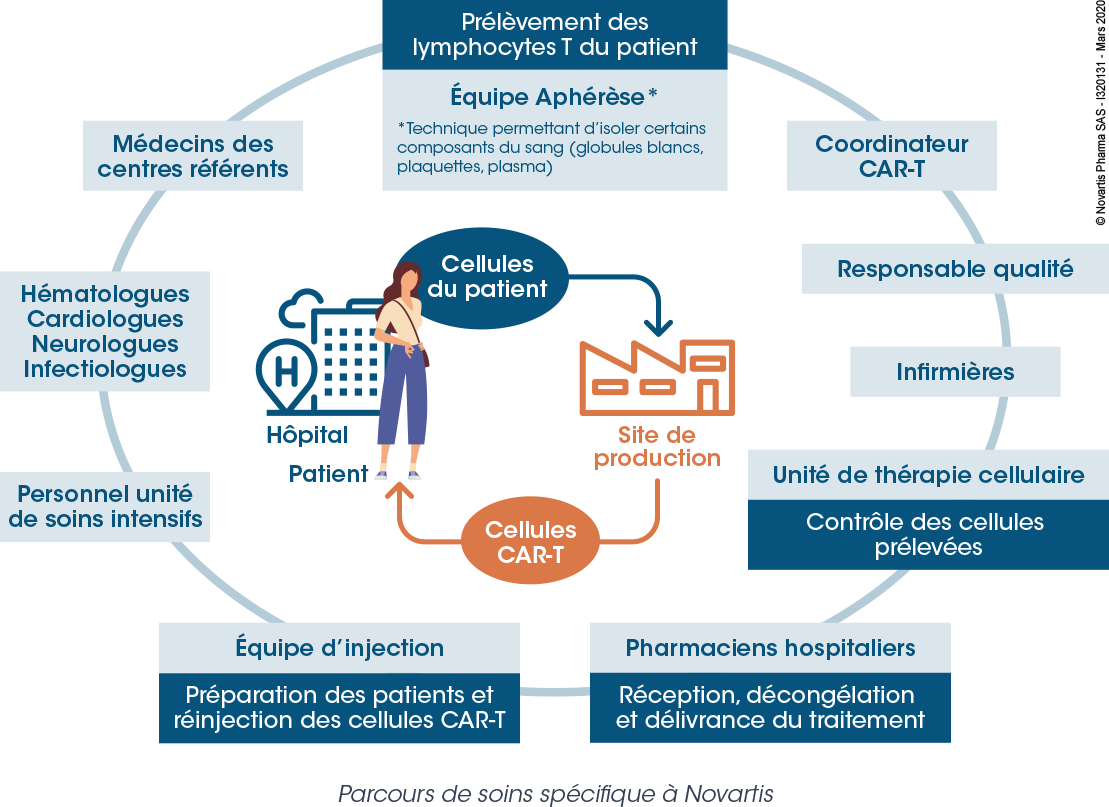
De nombreuses expertises impliquées
Le parcours de soins implique une équipe multidisciplinaire avec des acteurs intervenant à chaque étape du parcours, de la prescription au suivi du patient traité.
En plus du site de production, de nombreux services hospitaliers sont impliqués : service d’hématologie, service d’aphérèse (prélèvement des cellules), unité de thérapie cellulaire (contrôle qualité) pharmacie à usage intérieur (réception, décongélation et délivrance du médicament) et l’unité de soins intensifs (suivi du patient). L’ensemble des étapes de production nécessite une collaboration étroite entre les différents services et les différents acteurs impliqués, afin d’assurer une meilleure fluidité, une sécurisation du circuit, mais aussi d’éviter d’allonger les délais pour le patient.
Quel avenir pour les cellules CAR-T ?
Allogénique
Terme employé lorsque l’élément (cellules, organes) est prélevé chez un donneur pour être administré à un receveur qui est fortement, mais non entièrement, compatible avec le donneur sur le plan génétique.
Autologue
Terme employé lorsque l’élément (cellules, organes) est prélevé et administré à la même personne.
Antigène
Substance étrangère capable de déclencher la réponse du système immunitaire. Dans le cas des cellules CAR-T, l’antigène ciblé par le CAR est présent à la surface des cellules cancéreuses.
Myélome
Cancer du sang qui touche les plasmocytes (globules blancs).
Plèvre
Membrane enveloppant les poumons.
Hématologie
Science des maladies du sang.
Optimiser la production
La production des cellules CAR-T est un processus complexe, qui nécessite de nombreuses étapes de manipulation des cellules par des personnes qualifiées, dans des centres spécifiques. Une des pistes envisagée serait l’automatisation du processus afin de simplifier la production.
Développer d’autres cellules CAR-T
Différentes pistes d’amélioration des cellules CAR-T sont à l’étude.
• Cellules CAR-T allogéniques :  actuellement, les cellules CAR-T sont des produits autologues
actuellement, les cellules CAR-T sont des produits autologues  , mais des essais cliniques sont en cours afin d’obtenir des cellules CAR-T allogéniques. Dans ce cas, les lymphocytes T d’un donneur seront utilisés pour produire des cellules CAR-T qui seront réinjectées à un patient receveur (apparenté ou non). Cela nécessite de prendre en compte le degré de compatibilité entre le donneur et le receveur. Cette technologie offrirait l’avantage de disposer d’un stock de médicaments disponible immédiatement, ce qui supprimerait le circuit de production associé aux cellules CAR-T autologues.
, mais des essais cliniques sont en cours afin d’obtenir des cellules CAR-T allogéniques. Dans ce cas, les lymphocytes T d’un donneur seront utilisés pour produire des cellules CAR-T qui seront réinjectées à un patient receveur (apparenté ou non). Cela nécessite de prendre en compte le degré de compatibilité entre le donneur et le receveur. Cette technologie offrirait l’avantage de disposer d’un stock de médicaments disponible immédiatement, ce qui supprimerait le circuit de production associé aux cellules CAR-T autologues.
• Cellules CAR-T multi-spécifiques : le récepteur CAR est spécifique d’un seul antigène  . Hors il arrive parfois, qu’après traitement par les cellules CAR-T, les cellules cancéreuses n’expriment plus l’antigène ciblé, ce qui rend les cellules CAR-T incapables de les reconnaître. Une solution serait la production de cellules CAR-T exprimant différents récepteurs CAR, afin de cibler plusieurs antigènes, ou d’injecter plusieurs lots de cellules CAR-T au patient, un pour chaque antigène cible.
. Hors il arrive parfois, qu’après traitement par les cellules CAR-T, les cellules cancéreuses n’expriment plus l’antigène ciblé, ce qui rend les cellules CAR-T incapables de les reconnaître. Une solution serait la production de cellules CAR-T exprimant différents récepteurs CAR, afin de cibler plusieurs antigènes, ou d’injecter plusieurs lots de cellules CAR-T au patient, un pour chaque antigène cible.
Étendre l’utilisation des cellules CAR-T
De nombreux essais cliniques sont en cours, destinés à confirmer les premiers résultats obtenus et qui permettront de perfectionner ces traitements et d’élargir leur utilisation à d’autres pathologies, comme les autres cancers du sang et les tumeurs solides. Plusieurs essais sont actuellement en cours, avec des résultats prometteurs, notamment dans le myélome  , les cancers de la plèvre
, les cancers de la plèvre  et les cancers gastriques.
et les cancers gastriques.

Aujourd’hui,
plus de 900 essais cliniques
en cours sur les
cellules CAR-T
Êtes-vous incollable sur les cellules CAR-T ?
Venez tester vos connaissances en 6 questions !
Accéder au quiz
Vous êtes sur le point de quitter le site https:// www.therapies-geniques-cellulaires.fr et allez être redirigé vers un site externe.
Pour plus d’informations au sujet des liens hypertextes proposés, veuillez consultez nos conditions générales d’utilisation.
Cliquez sur Continuer pour poursuivre votre navigation ou sur Annuler pour revenir à la page précédente